Пиролиз древесины
Воспламенение и горение древесины есть следствие её нагрева до высоких температур в воздухе. В холодном состоянии древесина воздухом не окисляется. При нагреве древесина термически разрушается с образованием легкогорючих веществ, которые могут воспламеняться и поддерживать дальнейшее горение древесины. Поэтому для правильного понимания процессов горения необходимо знать как термически разрушается древесина.
Первичное термическое разрушение древесины происходит внутри полена, а значит без доступа воздуха (ввиду слабой газопроницаемости древесины). Термическое разрушение древесины в инертной среде (без доступа кислорода воздуха или иных окислителей) называется термической деструкцией, термическим разложением или пиролизом. В дальнейшем мы будем для краткости пользоваться термином «пиролиз», хотя сразу оговоримся, что «pyr» по-гречески означает огонь, и поэтому точнее было бы понимать под термином «пиролиз» разрушение в огне (то есть при горении в кислороде), а не разрушение в инертном газе. Так, например, в лесоведении «пирологией» называют науку о лесных пожарах и и вызываемых ими изменениях в лесу.
При нагревании древесины без доступа воздуха (такой процесс называется «сухой перегонкой») сначала при температурах 100-150°С происходит полное испарение всей свободной и связанной (гигроскопической) воды, затем при 150-275°С происходит начальный пиролиз с потреблением теплоты. При температурах 275-450°С происходят главные реакции распада веществ древесины, причём с бурным выделением тепла (с саморазогревом древесины). Наконец, при 450-550°С происходит последняя стадия пиролиза, требующая подвода теплоты извне и заканчивающаяся образованием древесного угля, сохраняющего анатомическое строение древесины. Промышленный древесный уголь по ГОСТ 7657-84 имеет «кажущуюся» (в воде) плотность 370 кг/м³, насыпную плотность после размола 210 кг/м³, температуру воспламенения 340°С, НКПВ пыли 128 г/м³, ПДК пыли 6 мг/м³. Древесный уголь в форме реальных «углей» (в виде обугленного слоя на древесине) имеет плотность 190 кг/м³, насыпную плотность (104-180) кг/м³, коэффициент теплопроводности 0,074 Вт/м•град. В результате всего цикла пиролиза образуется древесный уголь, жижка и горючие газы. Жижка при отстаивании разделяется на два слоя — верхний водный и нижний смоляной. Из водного слоя впоследствии выделяют уксусную кислоту, метиловый спирт, ацетон и другие продукты. Из смоляной части выделяют дёготь, жидкие топлива, антисептик креозот, которым пропитывают железнодорожные шпалы. Выход углей, жижки и газов составляет по массе соответственно 33%, 52% и 15% для берёзы и 38%, 44% и 18% для сосны.
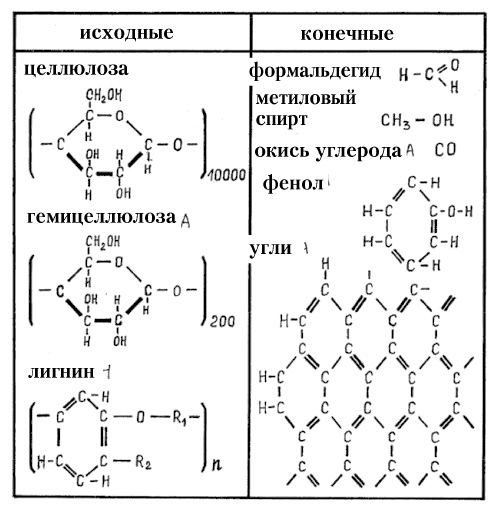 |
| Рис. 92. Химическая структура древесины и некоторых продуктов пиролиза (исходные и конечные продукты пиролиза древесины). Состав гимицеллюлозы приведён для гексозной части (пентозная часть содержит в кольце 5 углеродных атомов). |
Древесина состоит из трёх типов натуральных полимеров — длинноцепной целлюлозы, короткоцепных гемицеллюлоз (пентоз из пятичленных колец и гексоз из шестичленных колец) и лигнина, состоящего из бензольных колец (рис. 92). Пиролиз любых органических соединений идёт через разукрупнение (дробление, деление, разрыв, крекинг) молекул (и цепей молекул) с отделением кислородных соединений углерода, летучих углеводородов, молекул водорода и воды. Одновременно идёт агрегация углеводородных остатков в углерод через формирование бензольных колец C6H6 (рис. 92), которые объединяются в двойные бензольные кольца (нафталиновые), затем в тройные (антраценовые) и так далее вплоть до сеток колец (микрокристаллов графита, а также высших непредельных углеводородов CnHm). При пиролизе твёрдых углеводородов образуется кокс (в случае каменного угля) или древесный уголь (в случае древесины). При пиролизе углеводородных газов (метана, пропана и т. п.) и паров углеводородных жидкостей (бензина, керосина, бензола и т. п.) образуется газовзвесь мелких углеродных частиц (чёрный дым), при осаждении дающая сажу (копоть). В любом случае образуется углерод в так называемой аморфной форме — в виде микрокристаллического (рентгеноаморфного) графита, имеющего связи с С-Н, а потому легковоспламеняющегося. Наибольшее дымление даёт лигнин (которого очень много в коре берёзы), но лигнин даёт и в 1,5 раза больше тепла при сгорании, чем целлюлоза.
Считается, что пиролиз начинается с пентозной части гемицеллюлоз и лигнина. Наибольшую вероятность обугливания имеет лигнин, поскольку он уже содержит в своём составе бензольные кольца (рис. 92). В этом легко убедиться. Достаточно положить на разогревающуюся чугунную плиту дровяной печи (или комфорку кухонной электроплиты) оразец древесины (например, обычную осиновую спичку без головки) и образец материала из практически чистой целлюлозы — хлопка, льна, бумаги (непроклееных сортов, например, туалетной). Хлопок (в виде ваты или марли) начинает буреть при 220-240°С (именно поэтому максимальная стандартная температура утюгов устанавливается равной 220°С). Выделяющихся горячих газов глазами не видно, поскольку они абсолютно прозрачны и бесцветны (как воздух) вплоть до плазменных температур 5000-7000°С, а химических реакций горения, которые могли бы окрасить газ, пока нет (температуры самовоспламенения газов превышают 450°С). При температурах 320-340°С хлопок начинает чернеть и комкуется (сжимается), над хлопком появляется белый дымок — это пары выделяющихся труднокипящих жидкостей конденсируются в холодном воздухе, превращаясь в туман. Самовоспламенение в виде появления тления обугленного остатка наблюдается при температуре выше 440°С. Древесина (осиновая спичка) начинает буреть уже при температурах 180-190°С, начинает выделяться белый дымок (туман жидкостей) при 230-250°С, а при 300°С становится абсолютно чёрной с полным сохранением исходной формы спички. Это указывает, что сажа от разложения лигнина оседает на каркасе целлюлозы. Поскольку именно лигнин вызывает раннее выделение горючих газов и сажи, удаление лигнина гидролизом снижает пожароопасность и дымление древесины. Так. известно, что некоторые народы в древности для обогрева курных помещений использовали именно вымоченный в реке, а затем тщательно высушенный хворост.
Процессы пиролиза, как правило, завершаются при нагреве древесины до 500-600°С. Но если продукты пиролиза заключить в герметичную ёмкость (бомбу) и нагреть их до более высоких температур, то состав продуктов пиролиза изменится. Этот факт очень важен для анализа процессов горения, поэтому вкратце остановимся на основных особенностях вторичного пиролиза. Во-первых, жидкие и газообразные продукты первичного пиролиза разрушаются до простейших соединений (Н₂O,СO₂, СО, Н₂ и т. п.) и добавочного количества углерода как в форме древесного угля, так и в виде сажи (в том числе и в виде дыма). При этом даже метан образует сажу именно через бензольные кольца. Во-вторых, древесный уголь (углерод) начинает газифицироваться — реагировать с водяными парами С+Н₂О ↔ CO+H₂. Количество воды в продуктах пиролиза очень велико, что видно хотя бы из того, что балансовую химическую формулу целлюлозы и гемицеллюлозы (С6Н10О5) можно представить в виде (С6(Н20)5)n, то есть комбинации (смеси) углерода и воды (поэтому целлюлозу называют углеводом). Приведём расчётный состав продуктов реакции газификации углерода в синтез-газ С+Н₂О→СО+Н₂ в условиях атмосферного давления газовой фазы рₒ=р(Н₂О)+р(СО)+р(Н₂) =1 атм, где р(Н₂О), р(СО) и р(Н₂) — парциальные давления водяных паров, окиси углерода (угарного газа) и водорода соответственно:
| Температура, °С | 700 | 800 | 900 | 1000 | 1100 |
| Температура, °K | 973 | 1073 | 1173 | 1273 | 1373 |
| р(Н₂О) в % об. (10⁻² атм) | 90,66 | 65,94 | 29,38 | 8,1 | 2,08 |
| р(СО) в % об. (10⁻² атм) | 4,67 | 17,03 | 35,31 | 45,95 | 48,96 |
| р(Н₂) в % об. (10⁻² атм) |
Приведённые численные данные могут быть легко перечитаны на другие давления газовой среды рₒ, исходя из соотношений равновесия p(C) •p(H₂O) = K₁(T) •p(CO) •p(H₂0), где р(С) — давление паров углерода (зависит только от температуры), K₁(T) — коэффициент равновесия реакции (зависит только от температуры), р(СО) = р(H₂O). При этом можно показать, что p(H₂O)/p(CO) = A₁(f₁(T)pₒ)¹/², где f₁(T) = K₁(T)/p(C), A₁ — коэффициент пропорциональности. Таким образом, снижение давления ро (то есть уменьшение количества воды) приводит к сдвигу реакции вправо (то есть к более высокому преобразованию Н₂О в СО).
В-третьих, древесный уголь (углерод) начинает газифицироваться в ходе реакции С+СО₂ ↔ 2СО. Приведём расчётный состав продуктов реакции при давлении газовой среды рₒ = р(СО₂)+(СО)=1 атм:
| Температура, °С | 600 | 700 | 800 | 900 | 1000 | 1100 | 1200 |
| Температура, °K | 873 | 973 | 1073 | 1173 | 1273 | 1373 | 1473 |
| р(CO₂) в % об. (10⁻² атм) | 99,86 | 98,38 | 90,05 | 64,7 | 27,2 | 8 | 2 |
| р(СО) в % об. (10⁻² атм) | 0,14 | 1,62 | 9,95 | 35,3 | 72,8 | 92 | 98 |
Пересчёт на другие давления ведётся по соотношениям р(С)р(СО₂)=K₂(Т)р²(СО), f₂(T)=K₂(T)/p(C). При этом р(СО₂)/р(СО) =A₂(f₂(T)pₒ)¹/², то есть снижение давления рₒ сдвигает реакцию вправо. В целом, реакция углерода с СО₂ (углекислым газом) начинается примерно при температурах на 100°С выше, чем реакция с Н₂О (водой), а учитывая, что воды в продуктах пиролиза намного больше, чем углекислого газа, то реакция газификации водой является ведущей.
Продукты высокотемпературного «вторичного» пиролиза, состоящие преимущественно из СО и Н₂, называются синтез-газом или газогенераторными газами. Такие газы вырабатывались в первой половине XX века в огромных масштабах для лесохимических производств, отопления, а также для использования в качестве топлива в двигателях внутреннего сгорания. До сих пор часто вспоминают довоенные советские грузовики-полуторки с бортовыми газогенераторами, вырабатывавшими для своего двигателя горючий синтез-газ из древесных чурок длиной сантиметров десять, которые по государственному план-заказу (разнарядке) заготавливались колхозами в огромных количествах.
Характер термического разрушения древесины при температурах ниже 300-350°С практически не зависит от того, в инертной среде или воздушной ведётся нагрев древесины. При более высоких температурах уже возможны процессы дополнительного окисления свободным кислородом CnHmOk +O₂ ® СО₂+Н₂О, в том числе аморфного углерода по реакции С+О₂ ® CO₂. Пиролиз называется окислительным в том случае, когда количество вводимого кислорода настолько мало, что теплота окисления остаётся намного меньшей, чем подвод тепла для пиролиза извне. Если же количество подводимого кислорода уже начинает обеспечивать большую величину теплового эффекта окисления, то окислительный пиролиз приобретает название горения.
В заключение напомним, что сухая безводная окись углерода СО (угарный газ) практически не реагирует с кислородом О₂ до температуры 700°С. Выше 700°С протекает медленная гетерогенная реакция, то есть реакция идёт не в объёме, а с первоначальной сорбцией СО на поверхности твёрдых материалов. Причём некоторые вещества способны существенно снизить температуру окисления СО (например, в составе катализаторов для очистки выхлопных газов автомобилей от угарного газа). На скорость окисления углерода сильно влияет присутствие даже небольших количеств водяного пара или водорода, при этом реакция может стать даже гомогенной (в объёме) вне поверхностей твёрдых материалов.
Источник: health.totalarch.com. Дачные бани и печи. Принципы конструирования. Хошев Ю.М. 2008


Добавить комментарий